الماء هو سائل شفّاف بغير لون ولا طعم ولا رائحة،
الماء هو سائل شفّاف بغير لون ولا طعم ولا رائحة، يوجد في الكرة الأرضية في المسطّحات المائيّة من الجداول والبحيرات والبحار والمحيطات أو يتساقط عليها على شكل أمطار. كما يعدّ المكوّن الأساسي للسوائل في جميع الكائنات الحيّة. كيميائياً، يعدّ الماء أشهر المركّبات على الإطلاق، ويتألّفجزيء الماء من ثلاث ذرّات: ذرّتي هيدروجين وذرّة أكسجين ترتبط ببعضها برابطة تساهميّة، أما صيغته فهي H2O. يكون الماء سائلا عند الظروف القياسية من الضغط ودرجة الحرارة، ولكنّ له حالات أخرى شائعة الوجود أيضاً؛ وهي الحالة الصلبة على شكل جليد والحالة الغازيّة على شكلبخار ماء.
إنّ الماء هو أساس وجود الحياة على الأرض، وهو يغطّي 71% من سطحها.[1] تمثل مياه البحار والمحيطات أكبر نسبة للماء على الأرض، حيث تبلغ حوالي 96.5%. وتتوزّع النسب الباقية بين المياه الجوفيّة وبين جليد المناطق القطبيّة (1.7% لكليهما)، مع وجود نسبة صغيرة على شكل بخار ماء معلّق في الهواء على هيئة سحاب (غيوم)، وأحياناً أخرى على هيئة ضباب أو ندى، بالإضافة إلى الهطولات المطريّة أو الثلجيّة.[2][3] تبلغ نسبة الماء العذب حوالي 2.5% فقط من الماء الموجود على الأرض، وأغلب هذه الكمّيّة (حوالي 99%) موجودة في الكتل الجليديّة في المناطق القطبيّة، في حين تتواجد 0.3% من الماء العذب في الأنهار والبحيرات وفي الغلاف الجوّي.[2]
في الطبيعة، تتغيّر حالة الماء بين الحالات الثلاثة للمادة على سطح الأرض باستمرار من خلال ما يعرف باسم الدورة المائيّة (أو دورة الماء)، والتي تتضمّن حدوث تبخّر ونتح (نتح تبخّري) ثم تكثيف فهطول ثم جريان لتصل إلى المصبّ في المسطّحات المائيّة.
شكّل الحصول على مصدر نقي من مياه الشرب أمراً مهمّاً لنشوء الحضارات عبر التاريخ. وفي العقود الأخيرة، سجلت حالات شحّ في المياه العذبة في مناطق عديدة من العالم، قدّرت إحصاءات الأمم المتّحدة أنّ حوالي مليار شخص على سطح الأرض لا يزالون يفتقرون لوسيلة للوصول إلى مصدر آمن لمياه الشرب، وأنّ حوالي 2.5 مليار يفتقرون إلى وسيلة ملائمة من أجل تطهير المياه.[4]
محتويات
[أخف]الخصائص الفيزيائية والكيميائية[عدل]
 مقالات مفصلة: خصائص الماء
مقالات مفصلة: خصائص الماء- صفحة بيانات الماء
يمكن إيراد الخصائص الكيميائيّة والفيزيائيّة الأساسيّة للماء على شكل النقاط التالية:
- الماء سائل عند ظروف الضغط والحرارة القياسيّة المحيطة وذلك عند 298.15 كلفن (25 °س) وضغط 100,000 باسكال (1 بار، 14.5 بساي، 0.99 جو)، وهو عديم المذاق، كما أنّه عديم اللون عندما يكون بكمّيّات صغيرة، إلّا أنّه يأخذ لوناً أزرق عند ازدياد عمق الطبقات، وتلك خاصّيّة في أصل وجوهر الماء، ويعود سببها إلى امتصاص انتقائي في المجال الأحمر من الطيف المرئي وتبعثر للضوء الأبيض،[5] أمّا بخار الماء فهو أساساً غاز عديم اللون.[6]
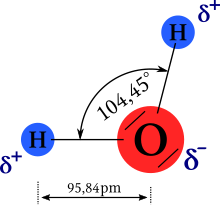
- تتكون بنية الماء الجزيئيّة نظريّاً بحيث تقع ذرّة الأكسجين في مركز بنية جزيئيّة رباعيّة السطوح تقع فيها ذرّتا الهيدروجين بالإضافة إلى الزوجين الإلكترونيّين (الموجودين على ذرّة الأكسجين) على زوايا الشكل رباعي السطوح. ولكنّ الشائع أنّ البنية الجزيئيّة للماء منحنية وغير خطّيّة، إذ تبلغزاوية الرابطة H-O-H مقدار 104.45°. تلك القيمة من زاوية الرابطة أصغر من القيمة النظاميّة لرباعي السطوح 109.47، ويعود ذلك إلى تدافع الزوجين الإلكترونيين ليشغلا أبعد مسافة ممكنة عن بعضهما حسب نظرية فيسبر. يبلغ طول الرابطة O-H في جزيء الماء 95.84 بيكومتر.
- بما أنّ كهرسلبية ذرّة الأكسجين حسب مقياس باولنغ (3.5) أعلى من ذرّة الهيدروجين (2.1)، تحمل ذرّة الأكسجين شحنة سالبة جزئية؛ في حين تحمل ذرّة الهيدروجين شحنة موجبة جزئية، بالتالي يكون الماء جزيئاً قطبيّاً ذا عزم ثنائي قطب يبلغ مقداره 1.84 ديباي. يستطيع الماء على أساس ذلك أن يشكّل روابط هيدروجينيّة بين جزيئيّة. تؤدّي هذه العوامل إلى وجود قوّة ترابط بين جزيئيّة قويّة، ممّا يفسّر ظهور خاصّيّة التوتّر السطحي الكبيرة للماء،[7] بالإضافة إلى الخاصّيّة الشعريّة. تفسّر خاصّيّة التوتّر السطحي للماء ظاهرة إمكانيّة وقوف الحشرات خفيفة الوزن على سطح الماء، بالإضافة إلى إمكانيّة تشكّل القطرات؛ في حين أنّ الخاصّيّة الشعريّة، والتي تشير إلى ميل الماء إلى الصعود إلى أعلى أنبوب شعري رفيع بشكل معاكس لقوة الجاذبية، خاصية مهمة وحيوية عند النباتات الوعائية مثل الأشجار.[8]
- يعدّ الماء من المذيبات القطبيّة الجيّدة، وعادةً ما يشار إليه على أنّه "مذيب عام". تُعرَّف المواد الكيميائيّة القابلة للانحلال (الذوبان) في الماء بأنّها مواد محبّة للماء (هيدروفيليّة)، مثل الأملاح والسكّريّات والأحماض والقلويّات وبعض الغازات مثل الأكسجين وثنائي أكسيد الكربون. بالمقابل، تعرّف المواد الكيميائيّة التي تكون غير قابلة للامتزاج مع الماء (مثل الدهنيّات (الزيوت والشحوم وغيرها) بأنّها كارهة للماء (هيدروفوبيّة). من جهة أخرى يمتزج الماء مع العديد من السوائل كالكحولات (الإيثانول مثلاً) بكافة النسب مشكّلاً مزيجاً له صفات معيّنة، منها كونه ثابت الغليان (مزيج أزيوتروبي). ولكن بالمقابل لا يمتزج الماء مع أغلب الزيوت العضويّة، إذ تشكّل الأخيرة طبقة ذات كثافة أقل تطفو على سطح الماء.
- تعتمد قيمة نقطة غليان الماء (كما هو الحال في كافة السوائل) على قيمة الضغط الجوّي المحيط. على سبيل المثال، فإنّ الماء النقيّ يغلي عند مستوى سطح البحر عند الدرجة 100 °س، في حين أنّه يغلي عند الدرجة 68 °س عند قمّة جبل إيفرست (8,848 م فوق سطح البحر). عند إذابة المواد القابلة للانحلال في الماء ترتفع نقطة غليان الماء وتنخفض نقطة تجمّده.[9]
- تبلغ قيمة السعة الحراريّة النوعيّة للماء 4181.3 جول/(كغ·كلفن)، وهي قيمة مرتفعة نسبياً بالمقارنة مع باقي المركّبات الكيميائيّة، كما أنّ حرارة التبخّر لديه مرتفعة (2257 كيلوجول/كغ) أيضاً. يعود ارتفاع هذه القيم إلى الروابط الهيدروجينيّة بين جزيئات الماء. تساهم تلك القيم المرتفعة في جعل مناخ الأرض معتدلاً وذلك بامتصاص التباينات والتأرجحات الكبيرة في درجة الحرارة.
- للماء كثافة مقدارها 1000 كغ/م3 (تعادل 1 غ/مل) عند الدرجة 4° س، أمّا الجليد فكثافته تبلغ 917 كغ/م3. تكون لكثافة الماء قيمة أعظمية عند الدرجة 3.98 °س،[10] وبعد ذلك تميل للتناقص، وذلك على العكس من أغلب المواد النقيّة الأخرى، والتي تزداد كثافتها عندما تنخفض درجة حرارتها. يعود التناقص في قيمة الكثافة إلى البنية المفتوحة غير المتراصّة للجليد والذي يبدأ بالتشكّل تدريجيّاً في الماء ذي درجة الحرارة المنخفضة (دون 3.98 °س)، إذ لا توجد طاقة حرارية كافية لتأمين توجّهات الحركة العشوائيّة للجزيئات، ممّا يؤدّي إلى اصطفافها على المستوى الجزيئي ولكن ببنية مفتوحة منتظمة، ممّا يؤدّي إلى ازدياد الحجم العام للسائل؛ ولذلك فإنّه بين درجتي الحرارة 3.98 °س و 0 °س يزداد الحجم مع تناقص درجة الحرارة.[11] يتمدّد الماء ليشغل حجماً أكبر بنسبة 9% من حجم الجليد، بالتالي ستكون كثافة الجليد أقلّ من كثافة الماء، لذلك يطفو الجليد على سطح الماء السائل، كما هو الحال في الجبال الجليديّة.
- للماء النقي موصليّة كهربائيّة ضعيفة، ولكنّها تزداد عند إذابة كمّيّة قليلة من مادّة أيونيّة مثل كلوريد الصوديوم.
- عند تطبيق طاقة كافية على الماء تفوق كمّيّة الحرارة القياسيّة للتكوين والتي تبلغ 285.8 كيلوجول/مول (15.9 ميغاجول/كغ) يحدث عندئذ انفصام لجزيء الماء إلى مكوّناته من الهيدروجين والأكسجين، وهذا ما يحدث عند تطبيق جهد مرتفع من التيّار الكهربائي بشروط معيّنة للحصول على ظاهرةالتحليل الكهربائي للماء. إنّ الطاقة اللازمة لفصم الماء إلى الهيدروجين والأكسجين عبر التحليل الكهربائي أو وسيلة أخرى تفوق الطاقة المستحصلة من تفاعل اتحاد العنصرين المذكورين.[12] يمكن أن يتم التحليل الكهربائي للماء على مستوى تعليمي عبر جهاز هوفمان لتحليل الماء:
- يصنّف الماء كيميائيّاً على أنّه أكسيد للهيدروجين، وهو يتشكّل عندما يحترق الهيدروجين أو أيّ مركّب حاوٍ عليه بالأكسجين، وهو مزيج انفجاري. تستطيع العناصر الكيميائيّة الأكثر كهرسلبية من الهيدروجين مثل الليثيوم والصوديوم والكالسيوم والبوتاسيوم والسيزيوم أن تزيح الهيدروجين من الماء مشكّلة بذلك الهيدروكسيدات الموافقة.
- يوصف الماء بأنّه عَسِر عندما تكون نسبة الأملاح المعدنيّة في الماء عالية، وخاصّة أملاح الكالسيوم (Ca+2) والمغنسيوم (Mg+2)، بالإضافة إلى بعض الأملاح المنحلّة من البيكربونات والكبريتات. بالمقابل، يوصف الماء غير العسر أنه "ماء يَسِر"، ويختلف تعريفه حسب الدولة، فهو الذي تركيزه من الأملاح أخفض من 100 مغ/ل في المملكة المتّحدة،[13] وأخفض من 60 مغ/ل في الولايات المتّحدة الأمريكيّة.[14] لهذه الخاصّيّة أهمّيّة في الصناعة بشكل خاص وخاصة في المراجل عند التبخير، كما أنّ لها تأثير على الصحّة، لذلك تخضع عادة إلى عملية إزالة للعسر.
- يمكن إجراء تفاعل كشف عن الماء بأساليب لاعضويّة تقليديّة، إذ أنّ الماء يلوّن ملح كبريتات النحاس الثنائي اللامائي أبيض اللون إلى اللون الأزرق، كما يتحوّل لون الورق المشبّع بملح كلوريد الكوبالت الثنائي اللامائي من الأزرق إلى الأحمر عند التماس مع الماء. أمّا تحليليّلاً فتحدّد كمّيّة الماء باستخدام طريقة كارل-فيشر.
- التعادل الحمضي: الماء سائل متعادل كيميائيّاً، إذ أنّ درجة الحموضة أو القاعدية فيه هي 7، وهذا يعني أنّه لا يمكن اعتبار الماء مادّة حمضيّة أو قاعديّة، لأنه مادّة متعادلة كيميائيّاً.
- حسب توزّع نظائر الهيدروجين وتركيبها فيمكن لجزيء الماء أن يكون بالإضافة إلى الشكل الشائع "الخفيف" على شكل ماء ثقيل عندما يكون نظير الهيدروجين الديوتيريوم مكان الأول في جزيء الماء (D2O)، كما يمكن أن يكون على الشكل ماء فائق الثقل عندما يحلّ التريتيوم مكان الهيدروجين في جزيء الماء (T2O).
| الخاصّيّة | ملاحظات | الأهمّيّة |
|---|---|---|
| حالات المادّة | المادّة الوحيدة التي توجد طبيعياً في حالاتها الثلاثة (أطوار المادة) على شكل صلب وسائل وغازي على سطح الأرض | انتقال الحرارة بين المحيط والغلاف الجوّي عبر التحوّل الطوري. |
| قابليّة الإذابة | يستطيع الماء إذابة الكثير من المواد بكمّيّات جيّدة بشكل أكبر من أيّ مادّة سائلة معروفة | خاصّيّة مهمّة جدّاً في العمليّات الكيميائيّة والفيزيائيّة والحيويّة. |
| الكثافة الكتليّة | تحدّد قيمة كثافة الماء حسب درجة الحرارة والملوحة والضغط (العوامل مرتّبة حسب الأهمّيّة). تبلغ كثافة الماء النقي قيمتها العظمى عند 4 °س، أمّا مياه البحر فإنّ نقطة التجمّد تتناقص مع ازدياد الملوحة |
خاصّيّة تتحكّم في الجريان العمودي للتيّارات المائيّة في المحيطات، وتساهم في توزيع الحرارة، وتساهم في التدرّج المائي الموسمي.
|
| التوتّر السطحي | أعلى قيمة بين السوائل الشائعة | تتحكّم في تشكّل القطرات؛ مهمّة في علم وظائف الخليّة في جسم الإنسان. |
| الموصليّة الحراريّة | أعلى قيمة بين السوائل الشائعة | مهمّة على نطاق ضيّق خاصة على المستوى الخلوي. |
| السعة الحراريّة | أعلى قيمة بين السوائل الشائعة | تفيد في امتصاص التقلّبات في درجة الحرارة والحفاظ على اعتدال مناخ الأرض. |
| حرارة الانصهار | أعلى قيمة بين السوائل الشائعة | التحكّم في الحرارة وضبطها كأثر لانتشار الحرارة عند التجمّد وامتصاصها عند الانصهار. |
| قرينة الانكسار | تزيد مع ازدياد الملوحة وتتناقص مع ازدياد درجة الحرارة | تبدو الأشياء أقرب منها في الماء من الهواء. |
| الشفافيّة | عالية في المجال المرئي، والامتصاص يتم في المجال تحت الأحمر وفوق البنفسجي | مهمّة من أجل التركيب الضوئي. |
| نقل موجات الصوت | جيّدة بالمقارنة مع السوائل الأخرى | تمكّن من قياس الأعماق بالموجات الصوتيّة. |
| قابليّة الانضغاط | ضئيلة | تغيّر ضئيل للكثافة مع ازدياد العمق. |
| نقطة الغليان والانصهار | مرتفعة | تتيح وجود الماء على شكل سائل على سطح الأرض. |
الماء في الكون[عدل]
 مقالة مفصلة: ماء كوني
مقالة مفصلة: ماء كوني
باستثناء الماء الموجود على سطح الأرض، فإنّ معظم الماء الموجود في الكون هو نتاج ثانوي لولادة النجوم، والتي يترافق حدوثها بنشوء رياح تندفع خارجاً بقوّة، حاملةً معها الغاز والغبار. عندما يصطدم ذلك الدفق من المواد بالغاز المحيط بالجرم المولود يؤدّي ذلك إلى نشوء أمواج صدمة، ما يعمل على تسخين الغاز. يتشكل الماء الملاحظ في الكون بتلك الطريقة وبشكل سريع في ذلك الغاز المتكاثف الساخن.[15] ظهر في سنة 2011 تقرير عن اكتشاف سحابة هائلة من بخار الماء في الكون وبكمّيّات تفوق الكمّيّة الموجودة على الأرض ب 140 تريليون مرّة، في محيط نجم زائف يبعد حوالي 12 مليار سنة ضوئيّة عن الأرض. وقد استنتج من ذلك أنّ الماء موجود في الكون منذ بداية نشأئه.[16][17]
يوجد الماء في الكون على العموم بحالاته الثلاثة الصلبة والسائلة والغازيّة، بالإضافة لإمكانيّة افتراضيّة لوجوده على شكل يدعى «ماء فائق التأيّن»، حيث يتبلور الأكسجين وتبقى أيونات الهيدروجين عائمةً بشكل حرّ داخل الشبكة البلوريّة للأكسجين.[18] يوجد هذا الشكل افتراضياً تحت ضغط ودرجة حرارة كبيرين كما هو الحال في البنية الداخليّة لكوكبيأورانوس ونبتون.[19] يعد وجود الماء بحالاته الثلاثة في نفس الوقت أحد أسباب وجود الحياة على سطح كوكب الأرض. ويرجع ذلك لتموقع الأرض في النطاق الصالح للحياة في النظام الشمسي، بحيث لو أنّها كانت أقرب إلى الشمس أو أبعد منها بنسبة 5% من المسافة الحاليّة (أي حوالي 8 مليون كم) فإنّ الظروف التي تسمح بوجود الأشكال الثلاثة لن تكون متوفّرة، ممّا سيؤثّر على وجود الحياة.[20][21]
على شكل بخار ماء[عدل]
يوجد الماء بحالته الغازيّة على هيئة بخار ماء، وقد عثر في الكون على هذا الشكل من الماء في الغلاف الجوّي للعديد من الأجرام في مجرّة درب التبّانة؛ وذلك في كلّ من:
- الغلاف الجوّي للشمس وذلك بكمّيّات نزرة قابلة للقياس.[23]
- الغلاف الجوّي لعطارد بنسبة 3.4%، ولكن توجد كمّيّات أكبر في الغلاف الخارجي.[24]
- الغلاف الجوّي للزهرة بنسبة 0.002%.[25]
- الغلاف الجوّي للأرض بنسبة تقارب 0.40% بالنسبة لكامل طبقات الغلاف الجوّي، إلّا أنّها تتراوح بين 1-4% بالقرب من السطح، بالإضافة إلى وجود كمّيّات نزرة في الغلاف الجوّي للقمر.[26]
- الغلاف الجوّي للمريخ بنسبة 0.03 %.[27]
- الغلاف الجوّي للمشتري وذلك فقط في المواد المتطايرة بنسبة 0.0004%،[28] وكذلك في قمره أوروبا.[29]
- الغلاف الجوّي لزحل وذلك فقط في المواد المتطايرة، وكذلك في أقماره تيتان وديون وإنسيلادوس.[30]
- الغلاف الجوّي لأورانوس بكمّيّات نزرة دون 50 بار.[31]
- الغلاف الجوّي لنبتون وذلك في الطبقات العميقة.[32]
يوجد بخار الماء أيضاً في العديد من الأجرام الفلكيّة الأخرى داخل المجموعة الشمسيّة كما في الغلاف الجوي للكوكب القزم سيريس،[33] بالإضافة إلى الأجرام خارج المجموعة الشمسيّة بما في ذلك الغلاف الجوّي لكل من HD 189733 b،[34] وHD 209458 b،[35] و Tau Boötis b،[36] و HAT-P-11b،[37][38] و XO-1b، و WASP-12b و WASP-17b و WASP-19b.[39]
يوجد بخار الماء أيضاً في الغلاف الجوّي للنجوم وذلك بشكل لا يقتصر على النجوم الباردة فقط، إذ أنّه اكتشف حتى في النجوم الضخمة العملاقة مثل منكب الجوزاء ونجم الراقص في كوكبة الملتهب وقلب العقرب والسمّاك الرامح.[38][40] كما اكتشف بخار الماء أيضاً في الأقراص النجميّة الدوّارة بما في ذلك أكثر من نصف نجوم تي الثور مثل AA Tauri،[38] و TW Hydrae،[41][42] و IRC +10216،[43] و APM 08279+5255،[16][17] و S Persei.[40]
على شكل ماء سائل[عدل]
يوجد الماء السائل في الكون بشكل رئيسي على كوكب الأرض حيث يغطّي أكثر من 71% من مساحته، بالإضافة إلى ذلك توجد كمّيّات كبيرة من الماء داخل الأرض وذلك في الطبقات العميقة تحت القشرة الأرضيّة.[44] كما أنّ هناك دلائل على وجوده على سطح المريخ أيضاً ولكن بكمّيّات قليلة.[45]هناك أبحاث تشير إلى أنّ الماء السائل قد يوجد بكمّيّات معتبرة في قمر إنسيلادوس الذي يدور في فلك زحل، حيث توجد طبقة سماكتها حوالي 10 كم في عمق 30-40 كم تحت سطح القطب الجنوبي لذلك القمر،[46][47] كما يوجد في طبقة تحت سطح قمر تيتان، ومن المحتمل أن يكون ممزوجاً معالأمونيا.[48] أمّا قمر المشتري أوروبا فلسطحه ميّزات تشير إلى إمكانيّة وجود مياه محيط سائلة تحت سطحيّة،[49] كما يمكن للماء السائل أن يوجد على قمر المشتري غانيميد في طبقة محصورة بين الجليد مرتفع الضغط والصخر.[50]
على شكل جليد[عدل]
يوجد الماء على شكل جليد في الكون في العديد من الأجرام والكواكب مثل كوكب المريخ وذلك تحت الحطام الصخري وعند القطبين، كما يوجد في حلقات زحل،[51] وفي قطبي عطارد.[52]
كما يوجد الجليد على شكل صفائح جليديّة في الأرض وفي الفوّهات والصخور البركانيّة في القمر،[53][54] وفي أقمار أخرى مثل قمر شارون.[51]
الماء في الأرض[عدل]
 مقالات مفصلة: توزيع المياه على الأرض
مقالات مفصلة: توزيع المياه على الأرض- موارد مائية
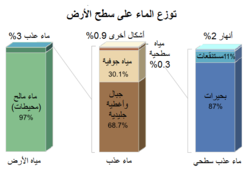
يوجد الماء على سطح الأرض في المسطّحات المائيّة والتي يمكن أن تكون على عدّة أشكال طبيعيّة مثل المحيطات والبحار والبحيرات والأنهار والجداول والبرك وغير ذلك، مع العلم أنّ أغلب الماء الموجود على سطح الأرض هو على شكل مياه مالحة في المحيطات والبحار، وخاصة في نصف الأرض الجنوبي حيث يوجد نصف الكرة المائي. تعرف كمّيّة الماء الكلّيّة الموجودة على الأرض ككلّ باسم غلاف الأرض المائي، ويقدّر حجمه بحوالي 1338 مليون كم3،[2] ومعظم هذه الكمّيّة (97%) عبارة عن ماء مالح في المحيطات، أما 3% المتبقيّة، والتي تكافئ حوالي 48 مليون كم3 فهيماء عذب، وحوالي ثلثي الماء العذب المتوفّر على الأرض هو جليد في القطبين على شكل مثالج وجبال جليديّة. تشكّل المياه الجوفيّة أغلب نسبة الثلث المتبقي من المياه العذبة (23.4 مليون كم3)، بحيث أنّ النسبة المتبقيّة من الماء العذب الموجودة في مجاري الأنهار وفي البحيرات الداخليّة (190 ألف كم3) وفي الغلاف الجوّي على شكل بخار ماء (13 ألف كم3) وفي الغلاف الصخري (16 ألف كم3) تبدو صغيرة نسبيّاً. إنّ أغلب ماء الأرض هو على شكل سائل (98.2%)، والباقي على شكل صلب (1.8 %)، مع وجود نسبة ضئيلة (0.001 %) على شكل بخار ماء. تجدر الإشارة إلى أنّ هذه النسب تقريبيّة وتشير إلى الحالة الراهنة، إذ حدثت تفاوتات كبيرة في تاريخ مناخ الكرة الأرضيّة.
دورة الماء[عدل]
 مقالة مفصلة: دورة الماء
مقالة مفصلة: دورة الماء
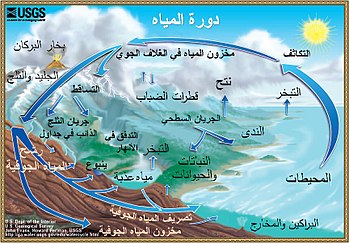
يشير مصطلح دورة الماء إلى التغيّر المستمرّ لحالات الماء ضمن الغلاف المائي للأرض وذلك بين الغلاف الجوّي للأرض والتربة والمياه السطحيّة والجوفيّة، بالإضافة إلى دور النباتات في تلك العمليّة.
تتضمّن دورة الماء انتقال الماء بشكل مستمر ودون انقطاع عبر العمليّات التالية:
- تبخّر الماء من المحيطات والمسطّحات المائيّة، بالإضافة إلى عمليّة النتح من نباتات اليابسة على شكل بخار ماء إلى الهواء.
- تكاثف بخار الماء من الهواء وحدوث هطولات تضمن عودة الماء بالتساقط على الأرض.
- جريان وصولاً إلى المحيطات والمسطّحات المائيّة.
يتكاثف أغلب بخار الماء الموجود فوق المحيطات ويعود إليها، ولكن أحياناً ما تحمل الرياح بخار الماء إلى اليابسة بحيث يمكن أن يحدث الهطول والتساقط عليها، وهذا الأمر يتعلّق بالمنطقة الجغرافيّة ومناخ المنطقة. يمكن للهطولات أن تكون على أشكال مختلفة، أشهرها الهطولات المطريّة، ولكن قد يحدث الهطول على شكل ثلج أو بَرَد، كما يسهم تشكلالضباب والندى في عملية الهطول أيضاً.[55] بالمقابل، يحدث القحط والجفاف عندما تمرّ فترات زمنيّة طويلة نسبيّاً قد تصل لشهور وأحياناً لسنوات دون هطول، ممّا يؤدّي إلى نقصان في مخزونها المائي تحت المعدّل الطبيعي لتلك المنطقة الجغرافيّة.
عند حدوث جريان الماء تتجمّع المياه على شكل مستجمعات، والتي تنجرف إلى الأنهار ومنها تكمل طريقها حسب مصبّها إلى المحيطات أو تتبخّر منها مباشرة. يعرف نموذج النقل الهيدرولوجي بأنّه إجراء عمليّة نمذجة رياضيّة لمحاكاة تدفّق نهر أو جدول، وحساب العوامل المؤثّرة على جودة الماء. يمكن أن يؤدّي الجريان إلى تعرية البيئة المحيطة ممّا يؤدّي إلى تشكيل الوديان أو مناطق جغرافية مميّزة وخصبة مثل الدلتا على سبيل المثال. يحدث الفيضان عندما تهطل كمّيّة كبيرة من الأمطار الغزيرة على أراضي منبسطة، بحيث أنّ معدّل الهطول في فترة زمنية يكون أكبر من معدّل التصريف، ممّا يؤدّي إلى ارتفاع مستوى المياه في الأنهار وغمرها للمناطق المحيطة.
التأثير على المناخ[عدل]
يقوم الماء بدور محوري في التأثير على مناخ الأرض، وهو أساس كافّة الظواهر المتعلّقة بالطقس وحالة الجوّ، ويعود ذلك إلى خاصّيّة الماء المتميّزة والمتمثّلة بالحركيّة والسعة الحراريّة العالية. يتمّ تخزين طاقة الشمس في مياه المحيطات، حيث يؤدّي ذلك إلى تبخّر المياه، إلّا أنّ نسبة التعرّض للشمس تتفاوت من مكان لآخر حسب المنطقة الجغرافيّة، ممّا يؤدّي إلى تفاوت في درجة حرارة المياه وفي نسبة الملوحة، والذي يسبّب في النهاية بحدوث تيّارات محيطيّة تنقل معها كمّيّات كبيرة من الطاقة (على شكل حرارة)، مثل تيار الخليج وتيار همبولت. إنّ حدوث تيار الخليج الدافئ له تأثير كبير على مناخ أوروبا، إذ لولاه لكان المناخ هناك قطبياً.
عندما تسخن مياه المحيطات يتبخّر الماء، وينتج نوعان من بخار الماء: "الجافّ" غير المتكاثف و"الرطب" المتكاثف على شكل سحاب وضباب، والذي يحوي وينقل الطاقة على شكل حرارة كامنة، والتي لها تأثير كبير على الظواهر الجوّية مثل الرطوبة الجوّيّة والعواصف الرعديّة.
تؤدّي الهطولات المطريّة و/أو الثلجيّة إلى تأمين المحتوى المائي في المناطق الجغرافيّة، وتكون نسبة النتح التبخرّي إلى الهطولات مهمّة في تحديد مناخ المنطقة الجغرافيّة إن كانت قاحلة (سهوب وصحاري) أو رطبة (غابات)، وذلك للتأثير المباشر على الغطاء النباتي.
ماء البحر والمد والجزر[عدل]
يحوي ماء البحر على نسبة من الأملاح الطبيعيّة (ما متوسطه 3.5%، أكثرها وفرةً ملح كلوريد الصوديوم)، بالإضافة إلى كمّيّات أصغر من مواد أخرى. تتراوح نسبة الملوحة في مياه البحار من 0.7% في بحر البلطيق إلى 4.0% في البحر الأحمر، في حين تصل نسبة الأملاح في البحر الميّت إلى حوالي 35%.
يسمّى ارتفاع منسوب مياه البحر عند الشاطئ وانحساره باسم ظاهرة المدّ والجزر على الترتيب. ويعود سببها إلى قوّة ناشئة ومتولّدة عن قوّة جاذبيّة القمر والشمس، والتي تؤثّر على مياه المحيطات. يؤدّي حدوث ظاهرة المدّ والجزر إلى تغيّر في عمق المسطّحات المائيّة المجاورة للشواطئ وخاصة عند مصاب الأنهار، ممّا يؤدّي إلى حدوث تيّارات اهتزازيّة تعرف باسم المجاري المدّيّة. إنّ التغيّر في منسوب مياه البحر أثناء المدّ والجزر في مكان جغرافي ما يتعلّق بحركة القمر والشمس ووموقعهما في لحظة معيّنة بالنسبة للأرض، ويترافق ذلك مع تأثير كوريوليس الحاصل من دوران الأرض حول نفسها، بالإضافة إلى العامل المتعلّق بمدى عمق تلك النقطة الجغرافيّة. تسمّى المنطقة الساحليّة التي تغمر تحت تأثير المدّ وينحسر عنها الماء أثناء الجزر باسم البحر الوحلي، وهي منطقة ذات أهمّيّة بيئيّة كبيرة.
الماء وعلوم الأرض[عدل]
يعرف العلم الذي يعنى بدراسة المياه وتوزيعها فوق الأرض وصفاتها وخصائصها الطبيعيّة والكيميائيّة وتفاعلها مع البيئة والكائنات الحيّة باسم علم المياه، في حين أنّ علم وصف المياه يختصّ بدراسة التوزيع والحركة على الأرض، أمّا دراسة المياه الجوفيّة من حيث التوزيع والحركة فهو علمالهيدروجيولوجيا. في حال كان التخصّص في دراسة الجليد فيعرف العلم باسم علم الجليد، وفي حال التخصّص بالمياه الداخلية فيعرف العلم باسم علم المسطّحات المائيّة الداخليّة، أمّا دراسة توزّع الماء في المحيطات والخصائص المتعلّقة فهو مجال اهتمام علم المحيطات.
يدخل الماء في العديد من العمليّات الجيولوجيّة المهمّة، حيث يوجد الماء في العديد من الصخور، ويؤثّر ذلك في تشكيل الصدوع، كما يسهم الماء في حدوث عمليّات التجوية الكيميائيّة والفيزيائيّة. تستطيع مياه الأمطار أن تتخلّل بعض أنواع الصخور المشكّلة للقشرة الأرضيّة بحيث تصل إلى طبقات المياه الجوفية. عندما تكون المياه الجوفيّة الموجودة في أعماق الأرض ضمن طبقات جيولوجيّة ساخنة فإنّ الماء يصعد إلى سطح الأرض على شكل مياه حمئة أو فوّارات حارّة.
الأهمّيّة الحيويّة[عدل]
الماء هو الحياة، ويمكن تفسير تلك المقولة من وجهة حيويّة بناءً على عدة خصائص مميّزة يقوم بها الماء، والتي هي أساسيّة لاستمرار الحياة على وجه الأرض. من بين تلك الخصائص الحيويّة قيامه بدور مذيب عام، إذ أنّ أغلب المواد الحيويّة تكون مذابة أو معلّقة فيه، ولهذا الأمر أهمّيّة في العمليّاتالاستقلابيّة، كما يشكّل الماء وسطاً حيوياً يسمح بقيام تفاعلات عضويّة حيويّة تؤدّي في النهاية إلى تأمين التناسخ الذاتي، ممّا يضمن استمرار التناسل وبقاء الكائنات الحية.
يعدّ الماء أساسيّاً لحدوث عملية التركيب الضوئي وبالتالي التنفس الخلوي عند الكائنات الحيّة. تقوم خلايا النباتات أثناء عمليّة التركيب الضوئي باستخدام طاقة الشمس لفصم الهيدروجين عن الأكسجين في جزيء الماء، حيث يتحدّ الهيدروجين مع ثنائي أكسيد الكربون CO2 ليشكّل الغلوكوز ويحرّر الأكسجين. بالمقابل تستخدم الكائنات الحيّة الأكسجين لتحرق السكر (الكربوهيدرات بشكل عام) لتحرر الماء وغاز ثنائي أكسيد الكربون من أجل تأمين الطاقة لاستمرار الحياة. للماء أيضاً دور مهمّ في تأمين وسط معتدل pH ~ 7، وبالتالي في عمل الإنزيمات. بالنهاية تحتاج كلّ الكائنات الحيّة إلى كمّيّات من الماء للقيام بعمليّاتها الحيويّة، مثل التخلص من الفضلات على سبيل المثال.
الماء أساس الحياة[عدل]
بدأت أول أشكال الحياة في الماء ومنها تطوّرت إلى أشكال الحياة المعروفة الآن. من الأمثلة المعروفة على أشكال الحياة البدائيّة وجود نوع من بكتيريا مختزلة للكبريت وهي بدائيّة النواة وذاتيّة التغذية وتنتج الطاقة من حدوث تفاعل أكسدة-اختزال بينكبريتيد الهيدروجين وثنائي أكسيد الكربون بوجود أشعة الشمس ممّا أسهم في الحصول على منتجات للكربون بالإضافة إلى الماء.
تلا ذلك وجود البكتريا الزرقاء وجميع أنواع حقيقيّات النوى ذاتيّة التغذية التي استخدمت الماء وثنائي أكسيد الكربون في تفاعل إنتاج الطاقة بوجود الضوء للحصول على الأكسجين والسكّر:
من خلال هذه العمليّة ارتفع منسوب غاز الأكسجين في الماء وفي الغلاف الجوّي، وبذلك أصبح من الممكن الحصول على الطاقة عن طريق التنفّس الخلوي.
على هذا الأساس أصبح الماء هو الوسط الرئيسي في جميع الكائنات الحيّة من أجل تمام عمليات الاستقلاب الكيميائيّة الحيويّة للحصول على الطاقة وتخزينها. ويتمثّل ذلك في العمليّات الحيويّة التالية: التركيب الضوئي وتحلّل السكّر وتحلّل الدهن ودورة حمض الستريك ودورة اليوريا. يعود الفضل في ذلك إلى كون الماء من المذيبات القطبيّة ممّا يسهم في إذابة الإلكتروليتات والمركّبّات القطبيّة، ومن جهة أخرى تسهم لزوجة وكثافة الماء الملائمة في كونه وسطاً ناقلاً للمركّبات اللاقطبيّة غير القابلة للذوبان في الماء، مثل المغذّيّات والدهون ونتائج التقويض والهدم الاستقلابي والهرمونات. بالتالي فالماء هو أساس الأوساط الناقلة مثل الدم والبلازما واللمف عند الثديّيات والنسيج الوعائي الخشبي عند النباتات.
يقوم الماء بالإضافة إلى ذلك في ضبط حرارة جسم الكائنات الحيّة وذلك على شكل إدماع (تعرّق النبات) أو على شكل عَرَق عند البشر والحيوانات. من جهة أخرى تستخدم النباتات وبعض الحيوانات اللافقارية ظاهرة ضغط الامتلاء (أو ضغط الانتباج) بالاعتماد على امتلاء محتوى الخليّة بالماء للقيام بتحريك بسيط للأعضاء. تلاحظ هذه الظاهرة لدى بعض النباتات عند تحريك الأوراق، كما تلاحظ أيضاً عند شوكيات الجلد مثل قنفذ البحر ونجم البحر وخيار البحر.
الحياة المائيّة[عدل]
 مقالات مفصلة: علم الأحياء المائية
مقالات مفصلة: علم الأحياء المائية- نبات مائي
تزخر مياه الأرض السطحيّة بعدّة أشكال من التنوّع الحيوي فيها، وتتناقص كلما ازداد العمق. تعتمد الحياة المائيّة في البحار والمحيطات في وجودها على الماء كعامل أساسي للكتلة الحيويّة، ويكون العامل المحدّد للإنتاجيّة هو كمّيّة ومقدار المغذّيّات النباتيّة المذابة مثل الفوسفات ومركّبات النتروجين مثل الأمونيوموالنترات بالإضافة إلى ثنائي أكسيد الكربون CO2.
تنمو بعض النباتات في الماء مثل الطحالب وتعدّ أساساً للعديد من النظم البيئيّة تحت سطح الماء؛ كما تعيش العوالق (البلانكتون) أيضاً تحت سطح الماء، وهي متعضّيّات صغيرة جداً، وهي ذات أهمّيّة بالغة، إذ تعدّ الأساس في وجود السلسلة الغذائيّة في المحيطات. إنّ أوّل ظهور للشكل البدائي للحياة كان في الماء؛ مع وجود أصناف عديدة من الأسماك والعديد من اللافقاريات التي تعيش في الماء فقط بالإضافة إلى وجود البرمائيّات والتي تقضي حياتها بين اليابسة والمياه. يستمر التدرّج في كبر وحجم الأنواع حتى الوصول إلى الثديّيات البحريّة.
تحتاج الفقاريّات المائيّة إلى الأكسجين لحياتها، وهي تفعل ذلك بطرق مختلفة. للأسماك مثلاً خياشيم بدلاً من الرئتين والتي تتمكّن من خلالها أن تعيش تحت الماء، رغم أنّه يتوفّر لدى بعض الأسماك مثل الأسماك الرئويّة كلا نظامي التنفّس. أمّا الثديّيات البحريّة مثل الدلفين والحوت وثعالب الماء وزعنفيّات الأقدام فهي تحتاج للصعود إلى السطح بشكل دوري لتنفّس الهواء. تقوم بعض البرمائيّات بالتنفّس عن طريق امتصاص الأكسجين من خلال جلدها. تمتلك اللافقاريّات العديد من التحويرات كي تبقى على قيد الحياة في بيئات ذات مياه فقيرة بالأكسجين وذلك باستخدام أنابيب تنفّس مثلاً.
يؤدّي تعلّق كثافة الماء بدرجة الحرارة إلى حدوث ظاهرة التطبُّق وإلى حدوث تيّارات مائيّة داخل كتلة الماء الموجودة في المسطّح المائي، والتي تعد ذات أهمّيّة كبيرة للموائل والأمكنة الحيوية في المياه العذبة وفي مياه المحيطات المالحة على حد سواء. إن شذوذ الكثافة لدى الماء يمكّن الكائنات البحريّة من البقاء على قيد الحياة في فصل الشتاء، إذ أنّ البيئات المائيّة بذلك لن تهبط عند التجمّد إلى القاع إنّما ستطفو على السطح.
الحياة البريّة[عدل]
يعدّ الماء أساسيّاً وعاملاً محدّداً للإنتاجية في النظم البيئيّة على الأرض، إذ أنّه ضروري الوجود من أجل عمليّة الاستقلاب عند الأحياء (الغلاف الحيوي)، كما له دور أساسي في تشكيل وتطبيع أماكن تواجدها، إن كان في غلاف الأرض الترابي أو الجوّي. تقوم الهطولات المطريّة و/أو الثلجيّة بتغذية المسطّحات المائيّة والمياه الجوفيّة كمصدر حيوي من أجل نمو النباتات ولتأمين مياه شرب للحيوانات.
يتم الاستفادة من خصائص الماء من قبل العديد من الكائنات الحيّة، فعلى سبيل المثال تستغل الحشرات والعنكبيّات خاصّيّة التوتّر السطحي للماء في حياتها اليوميّة بشكل كبير.
الإنسان[عدل]
إنّ حوالي ثلثي جسم الإنسان وزناً هو ماء، ممّا يبرز الأهمّيّة الحيويّة له بالنسبة لبقاء البشريّة. تتراوح نسبة الماء في الجسم بين 55% إلى 78% وذلك حسب الحجم.[56] عندما تنقص كمّيّة الماء في الجسم يشعر الإنسان بالعطش؛ إذ لا يستطيع الإنسان أن يعيش دون شرب ماء لفترة طويلة. يؤدّي نقصان كمّيّة الماء في الجسم إلى آثار صحّيّة سلبيّة كبيرة، مثل حدوث التجفاف، ممّا يؤدّي إلى تعطّل بعض وظائف الجسم التي تحتاج الماء كي تعمل بانتظام. يؤدّي عدم شرب كمّيّات كافية من الماء إلى حدوث شعور بالدوار والغثيان، واضطرابات في التروية الدموية، بالإضافة إلى تشنّجات عضليّة.[57]
تتفاوت التقديرات حول الكمّيّة الموصى بها لشرب الماء يوميّاً، ولكن لا ينبغي أن تقل عن 1.5 ليتر من الماء يوميّاً، وهي كمّيّة تقديريّة وسطيّة لتجنّب حدوث الجفاف (6-7 كاسات من الماء يوميّاً).[58][59] وللآن لا توجد أدلّة علميّة كافية تلزم الإنسان بشرب كمّيّة محدّدة من الماء يوميّاً، مثل القول أنه ينبغي شرب 8 كاسات من الماء كلّ يوم.[60] من جهة أخرى، هناك عدد من الدراسات التي ربطت بين الاستهلاك المرتفع لماء الشرب مع حدوث اضطرابات ومشاكل في الوزن.[61][62][63][64][65][66] ربّما تزداد الكمّيّة الموصى بها حسب المناخ، ففي البلدان ذات المناخ الحارّ يرتفع الطلب اليومي على شرب الماء، كما تزداد حاجة الجسم إلى الماء عند مزاولة جهد عضلي مثل الرياضة. بالمقابل، يؤدّي شرب كمّيّات فائضة من الماء عن الحاجة بشكل مبالغ يزيد عن 20 ليتر في اليوم إلى حدوث تسمّم بالماء وذلك بسبب حدوث اختلال توازن الكهرليتات ونقصان كمّيّة الأملاح في الجسم، وخاصّة نقص صوديوم الدم، ممّا يؤدّي إلى حدوث حالة تلف دائم في الخلايا العصبيّة تنتهي بالوفاة.[67][68][69]
الأهمّيّة بالنسبة للحضارة البشريّة[عدل]
للماء دور حيوي في بقاء وتقدّم الحضارة الإنسانيّة؛ حيث ازدهرت الحضارات البشريّة عبر العصور في وديان الأنهار الكبيرة الرئيسيّة؛ كما هو الحال في حضارة بلاد الرافدين، والتي تعرف باسم مهد الحضارة، إذ أنّها شهدت ازدهار عدّة حضارات وذلك بسبب الموقع الجغرافي المتميّز بين نهري دجلة والفرات، وقيل أنّها سمّيّت بالعراق أي «الشاطئ» لكثرة ووفرة مياهها، التي شكلت عامل جذب للعديد من الأقوام الذين سكنوها وشادوا فيها أرقى الحضارات.[ْ 1] كما أنّ حضارة المصريّين القدماء كانت قد تركّزت على ضفاف مجرى نهر النيل. بالإضافة إلى وادي السند في الهند وباكستان، ووادي هوانج في الصين. أنشأت كلّ هذه الحضارات أنظمة ريّ ساهمت في تطوير الأرض وجعلتها منتجة. وقد انهارت الحضارات حين نضوب موارد المياه أو عند إساءة استخدامها؛ إذ يعتقد كثير من المؤرّخين أنّ سقوط حضارة السومريّين في بلاد ما بين النهرين كان بسبب ضعف المهارة والخبرة في عمليّات الريّ. فقد تركّز الملح من مياه الريّ في الأرض بعد تبخّر المياه وأخذ يتراكم في التربة. وكان من الممكن تفادي تركّز الملح في التربة بغسل الملح بماء إضافي، وإذا لم يتمّ صرف ماء الأرض تصبح مشبّعة بالماء. فشل السومريون في تحقيق التوازن اللازم بين تركّز الملح في التربة وبين عمليات صرف المياه منها، وأدّت زيادة تركّز الملح في التربة وكذلك تشبّعها بالماء إلى الإضرار بالمحاصيل.[ْ 2] ومن ثم انخفض الناتج الزراعي تدريجيّاً وتفاقم نقص الغذاء، ومع انهيار الزراعة انهارت الحضارة السومريّة.
هناك عدد جيّد من حواضر المدن الكبيرة في العصر الحديث والتي يعود جزء من نجاحها إلى الموقع الجغرافي المائي المميّز، الذي يمكّن من الحركة التجاريّة كما هو الحال في هونغ كونغ وطوكيو وشنغهاي وروتردام ومونتريال.
يستخدم الماء العذب بشكل رئيسي في المجتمعات البشريّة كمصدر آمن لمياه الشرب، بالإضافة إلى استخدامه في قضاء الحاجات المنزليّة الأساسيّة فيما يخصّ الطبخ والنظافة الخاصّة والاستحمام. أمّا على صعيد خارجي فسيتخدم الماء بشكل أساسي في الزراعة، وخاصة من أجل الريّ، وكذلك في الصناعة وخاصة صناعة الغذاء.
تاريخ استخدام الماء[عدل]
منذ فجر الحضارة البشريّة أولى الإنسان أهمّيّة كبيرة لتطوير وسائل وطرق من أجل جلب المياه وتخزينها وذلك للأهمّيّة الحيويّة الكبيرة لهذه المادّة في حياة الإنسان. خلال العصر الحجري الحديث تمكّن الإنسان لأوّل مرة من حفر الآبار الدائمة، حيث كان يرفع الماء إلى الأعلى باستخدام الشادوف أو السواقي أو النواعير. كما انتشرت الآبار المدرّجة في عدّة مناطق في الهند، بالإضافة إلى وجود نظام تصريف معقّد للمياه في بعض المناطق في شبه القارة الهنديّة، كما هو الحال في موهينجو دارو في حضارة وادي السند.[70] كما عثر على نظام تصريف متقن للمياه أيضاً في آثار سكارا براي في إسكتلندا، والتي تعود إلى العصر الحجري الحديث.
كانت حضارة الإغريق القدماء في كريت، والتي تعرف باسم الحضارة المينوسيّة، من أوائل الحضارات التي استخدمت أنابيب من الخزف من أجل تزويد وتصريف المياه.[71] كما استخدم الإغريق في اليونان والأناضول نظام تصريف منزلي على شكل رشّاشات مضغوطة لغرض الاستحمام.[72] شقّ الرومان القدماءقنوات لجرّ الماء، وأنشأوا القنوات والخزّانات المائيّة في أرجاء إمبراطوريّتهم، ولا تزال العديد من الآثار الرومانيّة في مجال صرف المياه حاضرةً في العديد من الدول العربيّة على سبيل المثال في بلاد الشام وعلى طول ساحل الشمال الإفريقي. تمكّن الرومان بذلك من إنشاء نظام لجلب وتصريف المياه للمنازل وفي الساحات العامّة، حيث صمّمت النوافير والسبل العامّة. استخدم الرومان قديماً الرصاص لصنع الأنابيب، ممّا أدّى إلى انتشار حدوث حالات من تسمّم الرصاص في ذلك الوقت.[73] حفر الفرس أيضاً القنوات المائيّة في المدن والبلدات،[74] كما قاموا ببناء خزّانات من اللِّبْن تدعى باسم "آب انبار".
استمرّ التوسّع في شقّ القنوات وحفر الآبار مع ازدهار الحضارة الإسلاميّة، ومع التوسّع في إنشاء المواضئ في المساجد لأداء الصلوات، كما أنشئت الترع وحفرت العيون في الطرق والسبل العامّة، كما هو الحال في عين زبيدة التي حفرت خصيصاً للحجاج. بالإضافة إلى ذلك انتشر برع المهندسون في الأندلس على وجه الخصوص في تصميم النوافير وإيجاد حيل هندسيّة أصفت لمسات بديعة في فنّ العمارة كما هو الحال في نافورة بهو الأسود في قصر الحمراء في غرناطة.
كان التطوّر في تقنيّات استخدام المياه متزامناً في عدد من الحضارات، حيث تمكّن شعب المايا في بالينكي من تطوير قنوات مائيّة تحت أرضيّة ومن تصميم نظام تصريف شبيه بنظام المرحاض الحديث.[75][76] مع تقدّم العلوم والتطوّر في مواد البناء وعلوم الهندسة، بالإضافة إلى تحديث أساليب معالجة المياه أصبح من الممكن توفير أشكال مناسبة لتخزين المياه وتمديدها إلى البيوت وأماكن الإقامة، بحيث أصبح الوصول إليها سهلاً في العديد من المدن المتحضّرة.
الاستخدامات الأساسيّة[عدل]
الاستخدامات المنزليّة[عدل]
 مقالات مفصلة: ماء الشرب
مقالات مفصلة: ماء الشرب- صناعة المياه
يستخدم الماء على صعيد منزلي للشرب والطبخ والاستحمام ولغسل الملابس بشكل أساسي. يعني مفهوم صناعة المياه تزويد ماء الشرب وخدمات الصرف الصحي (بما في ذلك معالجة الصرف الصحي) إلى المنازل بوسائل مختلفة. تتضمّن الوسائل التي تؤمّن إمداد المياه كل من الآبار والخزّانات الأرضيّة من أجل الحصاد المائيوالتخزين بواسطة خزّانات وأبراج المياه والتغذية عن طريق شبكات وأنابيب المياه بالإضافة إلى وسائل تنقية المياه. تتولّى بلديّات المدن مسؤولية توزيع المياه للاستخدامات المنزليّة أو يمكن أن يتم الأمر عن طريق صهاريج. لغرض الترشيد في الموارد المائيّة العذبة تقوم بعض المدن مثل هونغ كونغ باستخدام مياه البحر دون معالجة من أجل شطف المراحيض في المنازل والمرافق العامّة.
كان ماء الشرب في السابق يجمع عادةً من الينابيع والجداول أو من حفر الآبار أو بضخّه من البحيرات والأنهار. في العصر الراهن يتطلّب الأمر معالجة المياه وتنقيتها لإزالة الشوائب باستخدام مرشّحات المياه والتي تكون عادة من الرمل، كما يتطلّب الأمر أيضاً تعقيم المياه للتخلّص من المواد الضارّة المنحلّة والميكروبات وذلك باستخدام كلورة المياه أو أساليب أخرى. يمكن معالجة المياه أيضاً باستخدام التناضح العكسي أو بتحلية مياه البحر.
يمثّل الماء أمراً جوهرياً فيما يخص أمور النظافة بشكل عام والنظافة الشخصيّة بشكل خاص، وذلك فيما يتعلّق بالاستحمام وغسل الملابس وتنظيف المنازل بالإضافة إلى جلي الأواني، حيث يستخدم لذلك بالإضافة إلى الماء الصابون والمواد المنظّفة الملائمة. كما يعدّ الماء أساسيّاً للطبخ حيث يستخدم بطرق مختلفة من أجل تحضيرالطعام وذلك إمّا بسلق الخضار والبيض في ماء مغلي، أو بإجراء الطهي عن طريق التبخير، أو السلق على نار هادئة، أو بالغلي عند درجات حرارة تقارب نقطة غليان الماء.
الزراعة[عدل]
 مقالة مفصلة: ري
مقالة مفصلة: ري
يعد الري الاستخدام الأهمّ للماء في الزراعة، وهو أساسي لإنتاج المحاصيل الغذائيّة. قد يصل سحب الماء من أجل ريّ المزروعات في بعض البلدان الناميّة إلى حوالي 90% من السحب الإجمالي،[77] وحتى في الدول المتقدّمة تصل نسبة سحب المياه من أجل الريّ إلى نسبة معتبرة، إذ أنّه في الولايات المتّحدة الأمريكيّة تصل نسبة السحب من المياه العذبة من أجل الري إلى حوالي 30%.[78]
ازدادت أهمّيّة الوعي حول الترشيد في استخدام الموارد المائيّة في العقود الأخيرة، خاصّة مع ازدياد عدد سكان الأرض وازدياد حاجتهم بالتالي إلى الماء للشرب وللري للحصول على الغذاء، ممّا دعا إلى حاجة تطوير وسائل مثل الري بالتنقيط. أدّى التمدّد الحضري بالإضافة إلى ارتفاع الطلب على المياه من قطاعات أخرى، مثل إنتاج الطاقة البديلة (الوقود الحيوي)، إلى الحديث عن مفهوم ذروة الماء.[79] يتوقّع في المستقبل أن يزداد الطلب على الماء بشكل أكبر ممّا هو عليه الآن وذلك لتأمين غذاء كاف مع تزايد عدد سكان الأرض، والذي يخمّن أن يصل إلى 9 بلايين في حلول سنة 2050.[80]
أجري تقييم لأسلوب إدارة المياه في الاستخدام الزراعي سنة 2007 من طرف المعهد الدولي لإدارة المياه في سريلانكا من أجل معرفة إن كان للعالم موارد من الماء كافيّة لتأمين الغذاء للعدد المتزايد من السكان في العالم.[81] قامت عملية التقييم على أساس وفرة المصادر المائيّة في تلك السنة لاستخدامها في الزراعة على صعيد العالم، وقدّمت تحديداً للمواقع التي تعاني من ندرة المياه، حيث وجد أن خمس تعداد السكان في العالم، أي أكثر من 1.2 بليون نسمة، يعيشون في مناطق تعاني من ندرة مادّيّة للمياه حيث لا توجد كمّيّة كافية من الماء لتلبية كافّة الحاجيّات الضروريّة. كما وجد أنّ 1.6 بليون نسمة في العالم يعيشون في مناطق ندرة اقتصاديّة للمياه، حيث أنّ نقص الاستثمارات وضعف الحالة الاقتصاديّة يجعل من المستحيل على الهيئات الحكوميّة في تلك المناطق أن تلبّي حاجة الطلب إلى المياه. خلص التقرير إلى أنّ الاستمرار على نفس الوتيرة الحاليّة من إنتاج الغذاء واستخدام مياه الري من أجل زراعة المحاصيل ستؤدّي بالنهاية إلى حدوث أزمات في العديد من المناطق في العالم، وأنّه يمكّن تجنّب ذلك عندما يقوم المزارعون بزيادة الكفاءة والإنتاجيّة وذلك بالتقليل قدر الإمكان من الهدر بالترشيد واستخدام وسائل حديثة في الريّ.[82]
الصناعة[عدل]
للماء أهمّيّة كبيرة في الصناعة وله العديد من التطبيقات. يستخدم الماء بشكل أساسي كمادّة تبريد ووسط في المبادلات الحراريّة نظراً لوفرته وللسعة الحراريّة المرتفعة سواءً للتبريد أو التسخين. يمكن الحصول على الماء البارد من مصادر طبيعيّة متوفّرة كنهر جار أو بحيرة قريبة أو من البحر، كما أن تسخين الماء لنقل الحرارة عمليّة فعّالة عن طريق تبخيروتكثيف الماء وذلك بسبب حرارة التبخر العالية له. بالمقابل، إنّ من سيّئات استخدام البخار هو تعرّض المواد المعدنيّة المستخدمة في الصناعة مثل الفولاذ والنحاس للتآكل عند استخدام ماء غير معالج. في كافّة المحطّات الحراريّة يكون الماء هو السائل المستخدم لنقل الحرارة بدخوله في دورة مغلقة بين المرجل والعنفات والمكثّف، كما يستخدم أيضاً كمادّة حراريّة ناقلة في أبراج التبريد. في المحطّات والمفاعلات النوويّة يستخدم الماء كمهدّئ للنيوترونات وكمادّة تبريد في نفس الوقت.
يدخل الماء العديد من التطبيقات المهمّة في الصناعات الكيميائيّة وذلك على شكل مذيب أو كاشف كيميائي؛ كما يستخدم في مختلف العمليّات الكيميائيّة كوسط للتفاعل على العموم وعلى الخصوص من أجل التنظيف والشطف (عادة مع مواد منظّفة أو محاليل قلويّة) أو للإذابة أو للاستخلاص ولإعادة التبلور. كما يستخدم الماء كوسط من أجل التحليل والطلي الكهربائي وفي صناعة البطّاريات.
في العمليّات التقنيّة المختلفة يستخدم الماء كوسط لربط وتشكيل الجبس والإسمنت، بالإضافة إلى استخدامه في التصديع والقطع والتنظيف عندما يوضع تحت ضغط مرتفع، بالإضافة إلى استخدامه كوسط لنقل الضغط في بعض التطبيقات الهيدروليكيّة.
يستفاد من الطاقة المائيّة على هيئة طاقة كهرمائيّة في توليد الكهرباء، وذلك من القوّة الناشئة عن دفع المياه للعنفات التي تكون موصولة بمولّد كهربائي. تعدّ الطاقة الكهرمائية إحدى الطاقات النظيفة المتجدّدة، والتي يحصل عليها عادة من إنشاء السدود على الأنهار.