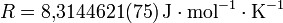الغاز هو أحد حالات المادة، ومثل السوائل فإن الغازات موائع أي أن لها قابلية للسريان ولا تقاوم تغيير شكلها، بالرغم من أن لها لزوجة.
الغاز هو أحد حالات المادة، ومثل السوائل فإن الغازات موائع أي أن لها قابلية للسريان ولا تقاوم تغيير شكلها، بالرغم من أن لها لزوجة. وعلى غير ما يحدث في السوائل، فإن الغازات حرة لا تشغل حجماً ثابتاً ولكنها تملأ أي فراغ يتاح لها. وطاقة حركة الغازات هي ثاني أهم شيء في حالات المادة (بعد البلازما). ونظراً لزيادة طاقة حركة الغازات فإن جزيئات وذرات الغاز تميل لأن تشغل كل حجم متاح لها ، بل النفاذ أيضا خلال حائل من مادة مسامية ، ويزداد ذلك بزيادة طاقة حركتها. ويوجد مفهوم خاطئ يتعلق بأن اصطدام الجزيئات ببعضها ضروري لمعرفة ضغطالغاز، ولكن الحقيقة أن سرعاتها العشوائية كافية لتحديد ضغطها. الاصطدامات بين الجزيئات مهمة فقط للتفاعلات الكيميائة حيث تفسر نظرية التصادم حدوث تفاعل بين جزيئات مادتين. كما يصف توزيع ماكسويل-بولتزمان توزيع سرعات الجزيئات في الغاز واعتمادها على درجة الحرارة ويأخذ الحركة الحرارية للغاز في الحسبان.
تختلف حركة جسيمات الغاز عن حركة جسيمات السوائل التي تتلامس. فعند تواجد جسيمات ، مثل حبيبات غبار في غاز نجد أنها تتحرك في حركة براونية، ونشاهد ذلك أحيانا في شعاع الشمس وحركة الغبار في الهواء. وحيث أنه لا توجد تقنية حالية تمكننا من ملاحظة حركة جسيم غازي (ذرة أو جزيئ)، فإن الحسابات النظرية فقط تعطي تصورا عن كيفية تحركهم ، ولكن حركة ذرات غاز أو غاز مكون من جزيئات (الأكسجين )أو النيتروجين حيث يتكون كل منهما من ذرتين مرتبطتين) فهي تختلف عن الحركة البروانية. والسبب في هذا أن الحركة البروانية تتضمن حركة جسيم غبار تحت تاثير محصلة اصطدامات ذرات الغاز بها. ويتكون جسيم الغبار غالباً من مليارات الذرات. ويتحرك في أشكال أشكال حادة عشوائيا.
محتويات
[أخف]نظرية الحركة الحرارية للغازات[عدل]
كان تطور الحركة الحرارية وفهم الغازات وسلوكها الباعث على تقدم الكيمياء والفيزياء منذ اكتشافت روبيرت بويل وصياغته لسلوكها في قانون بويل في عام 1662. ثم حدث تقدم سريع حتى القرن التاسع عشر ، واستطاع العلماء وصف الغاز كالأتي :
1-تتألف الغازات من أعداد كبيرة من الجسيمات المتناهية في الصغر والبعيدة عن بعضها مقارنة بحجمها. وينتج عن ذلك ان معظم الحجم الذي يحتله الغاز هو عبارة عن فراغ , وهذا يعلل الكثافة المنخفضة للغازات.
2- تتصادم جسيمات الغاز بعضها البعض بسبب حركتها السريعة العشوائية ، وبارتفاع درجة الحرارة تزداد سرعات الجزيئات ،وتشتد الاصطدامات ويزداد معدل الاصطدامات. في نفس الوقت تصطدم جسيمات الغاز بجدار الوعاء الذي يحتويها وتظهر لنا في صورة الضغط. التصادم مرن أي لا يحصل فقدان في الطاقة الكلية للغاز. كل مافي الأمر تنتقل السرعات بين الجسيمات مثلما تنتقل سرعات كرات البلياردو.
3- تكون جسيمات الغاز في طاقة حركة دائمة سريعة وعشوائية وفي جميع الاتجاهات.
4- لا توجد قوى تجاذب أو تنافر بين جزيئات الغاز (افتراض الغاز المثالي).
الضغط[عدل]
الرمز المستخدم لتمثيل الضغط في المعادلات هو "P" أو "p" مع وحدات SI من الباسكال. عندما نضع وعاء من الغاز، مصطلح الضغط (أو الضغط المطلق) يشير إلى متوسط القوة في وحدة المساحة الذي يطبقه الغاز على سطح الحاوية. في هذا الحجم، من الأسهل أحيانا تصوير جزيئات الغاز تتحرك في خطوط مستقيمة حتى تتصادم مع الحاوية (انظر الرسم البياني في أعلى المقال). قوة الكشف عنها من قبل الجسيمات الغاز في وعاء أثناء هذا التصادم هو التغير في زخم الجسيمات.[1] خلال الاصطدام فقط المكون الطبيعي للسرعة هو الذي يتغير. تسافر الجسيمات بشكل مواز لجدار الحاوية فلا يتغير زخمها. ولذلك يجب أن يكون متوسط القوة على السطح هو متوسط التغير في الزخم الخطي لكل تصادمات جسيمات الغاز. الضغط هو مجموع كل المكونات الطبيعية من القوة التي تمارسها الجزيئات و المؤثرة على جدران الحاوية مقسوما على مساحة سطح الجدار.
الحرارة[عدل]
الرمز المستخدم لتمثيل درجة الحرارة في المعادلات هو T مع وحدات SI من كلفن. سرعة جسيمات الغاز يتناسب مع درجة حرارته المطلقة.يتقلص حجم البالون عندما تبطئ سرعة جزيئات الغاز مع إضافة النيتروجين شديد البرودة. وترتبط درجة حرارة أي نظام فيزيائي بحركة الجزيئات (جزيئات والذرات) التي تشكل في مجموعها النظام الغاز.[2] في الميكانيكا الإحصائية، درجة الحرارة هي المقياس لمتوسط الطاقة الحركية المخزنة في الجسيمات.
الحجم[عدل]
الرمز المستخدم لتمثيل حجم محدد في المعادلات هو "V" مع وحدات SI من متر مكعب لكل كيلوغرام.
الكثافة[عدل]
الرمز المستخدم لتمثيل الكثافة في المعادلات هو ρ (رو) مع وحدات SI للكيلوغرام لكل متر مكعب.
معادلة الغاز المثالي[عدل]
 مقالة مفصلة: غاز مثالي
مقالة مفصلة: غاز مثالي
أو معادلة الحالة الحرارية لغاز مثالي وهي تصف غازا مثاليا وسلوكه عند تغير درجة الحرارة مثلا. وقد شكلت تلك المعادلة كنتيجة لنتائج تجارب عديدة (قوانين الغازات).ثم استطاع لودفيغ بولتزمان عن طريق حساب الاحتمالات (ترموديناميكا إحصائية) تفسير سلوك الغاز عل أساس بنية جسيمات الغاز.
تصف معادلة الغاز العامة دوال حالة غاز مثالي وعلاقات تلك الدوال بعضها ببعض من : درجة الحرارة ، والضغط وحجم الغاز ، وهي:
حيث:
ثابت الغازات العام ، كما أن :
- p الضغط
- V الحجم المولي
- T درجة الحرارة بالكلفن
- R ثابت الغازات العام
- n عدد المولات (أو أجزاء المول).
بواسطة المعادلة العامة للغازات بالإضافة إلى قوانين الديناميكا الحرارية يمكننا وصف عمليات الحركة الحرارية للغازات المثالية بطريقة الرياضيات .
معادلة الغاز الحقيقي[عدل]
 مقالة مفصلة: غاز حقيقي
مقالة مفصلة: غاز حقيقي
الغاز الحقيقي (بالإنجليزية: Real gas) هو غاز ليس غاز مثالي بتميز بصفات لا يمكن معالجتها بواسطة قانون الغازات المثالية. ولكي نفهم سلوك الغازات الحقيقية وهي تقابلنا باستمرار في حياتنا العملية حيث أنها تشغل المحركات ، كما أنها تؤثر على الطقس فلا بد من اتخاذ الصفات الآتية في الاعتبار:
- لها تأثيرات ضغطية
- حرارة نوعية متغيرة
- تأثير فان دير فالس (حيث للجزيئات أحجام تختلف عن الصفر) ،
- تأثيرات ترموديناميكية في حالة عدم التوازن ،
- تؤثر على تفكك الجزيئات وتؤثر على التفاعلات الكيميائية
بأخذ تلك المؤثرات في العتبار أو بعضها توجد عدة صيغ لحالة العاز الحقيقي ، نؤتي منها على سبيل المثال :
معادلة فان دير فالس[عدل]
 مقالة مفصلة: معادلة فان دير فالس
مقالة مفصلة: معادلة فان دير فالس
تتعامل مع الغازات الحقيقية باعتبار الكتلة المولية ووحجمها المولي:
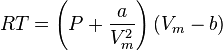
حيث:
- P الضغط.
- T درجة الحرارة|بالكلفن.
- R ثابت الغازات.
- الحجم المولي Vm.
a و b إحداثيان يُعينان عمليا لكل غاز ، وأحيانا يجري تعيينهما من النقطة الحرجة (Tc) والضغط الحرج (Pc) مع استخدام العلاقتين :